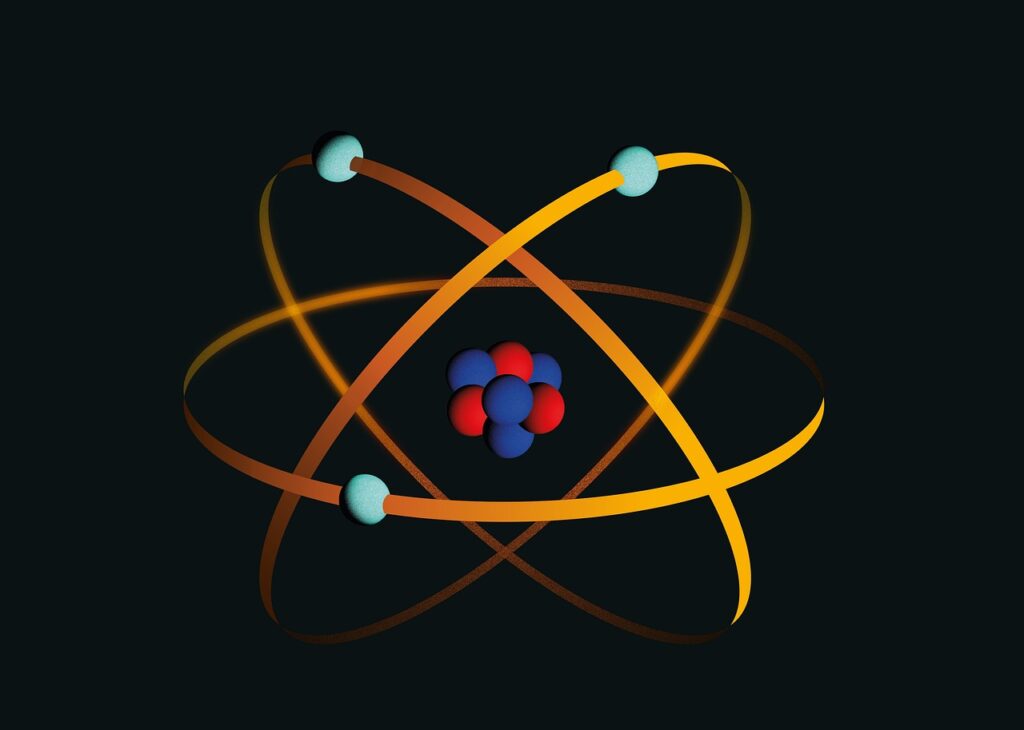
No modelo nuclear atual, um átomo é composto por um núcleo carregado positivamente, o qual é responsável por quase toda a sua massa. Ao redor do núcleo, há elétrons com carga negativa (representados por e-). Em relação ao tamanho do núcleo, que tem um diâmetro de cerca de 10-14 m, o espaço ocupado pelos elétrons é imenso, com um diâmetro aproximado de 10-9 m, cem mil vezes maior.
Os elétrons no átomo neutralizam de maneira precisa a carga positiva do núcleo central. Cada elétron tem uma carga negativa, o que significa que um núcleo contém uma partícula com carga positiva para cada elétron em movimento, conforme confirmado por experimentos em laboratório. Essas partículas com carga positiva são denominadas prótons (representados por p), e suas propriedades estão detalhadas na Tabela 1. Um próton tem aproximadamente 2000 vezes a massa de um elétron.
Tabela 1: Propriedades das partículas subatômicas
| Partícula | Símbolo | Carga* | Massa |
| elétron | e– | -1 | 9,109×10-31 |
| próton | p | +1 | 1,673×10-27 |
| nêutron | n | 0 | 1,675×10-27 |
*As cargas são dadas como múltiplos da carga de um próton. SI vale 1,602×10-19 C.
Número atômico
Primeiramente, o número atômico de um elemento é o número de prótons no núcleo atômico desse elemento, e é representado por Z. Por exemplo, o átomo de hidrogênio tem um próton, então seu número atômico é Z = 1; o átomo de hélio tem dois prótons, portanto seu número atômico é Z = 2. Henry Moseley, um jovem cientista britânico, foi o primeiro a determinar com precisão os números atômicos pouco antes de perder a vida na Primeira Guerra Mundial. Moseley realizou experimentos nos quais bombardeou elementos com elétrons rápidos e observou a emissão de raios X. Ele percebeu que as propriedades dos raios X emitidos por um elemento estavam relacionadas ao seu número atômico, e por meio do estudo desses raios X de vários elementos, ele foi capaz de determinar seus valores de Z. Desde então, os cientistas têm determinado o número atômico de todos os elementos conhecidos.
Os avanços tecnológicos na área da eletrônica no início do século XX possibilitaram a invenção do espectrômetro de massa, um instrumento que permite determinar a massa de um átomo. A espectrometria de massa tem sido amplamente utilizada para determinar as massas de todos os átomos dos elementos. Atualmente, sabemos que a massa de um átomo de hidrogênio é de 1,67 x 10-27 kg, enquanto a massa de um átomo de carbono é de 1,99 x 10-26 kg. As massas dos átomos mais pesados não ultrapassam aproximadamente 5 x 10-25 kg. Ao conhecer a massa de um átomo específico, é possível determinar o número de átomos em uma determinada amostra do elemento dividindo a massa da amostra pela massa do átomo.
Visite o site para mais informações sobre química, nosso canal do Youtube e o nosso ultimo post: Átomo